고객지원
기기원리
pH는 용액의 산성 및 염기성 정도를 나타내는 척도로 수소이온농도([H+])를 지수로 나타낸 것입니다. pH는 0에서 14까지 표현할 수 있고, pH 7은 중성, pH 7 미만은 산성,pH 7 초과는 염기성입니다. pH1의 변화는 수소이온농도 10배의변화를 나타내며, 전극상에서 59.16 mV의전위를가지고있습니다.

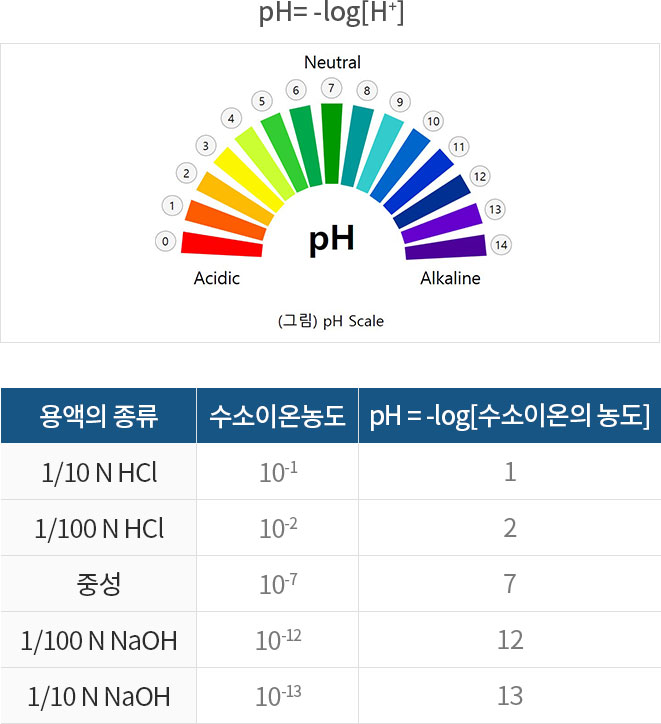
pH는 pH Paper나 지시약을 사용해서 색상의 변화로 측정할 수 있습니다. 지시약을 이용한 측정은 자체의 정확도에 한계가 있으며, 색깔을 가지고 있거나 어두운 시료들을 정확하게 측정하는데 어려움이 있습니다. 보다 정확한 측정은 pH Meter로 측정하는 방법입니다. pH 측정은 3가지 부분인 pH 전극, 기준전극, 고압력 증폭기로 구성됩니다.
pH 전극은 측정되는 용액의 pH에따라 변화되는 전극을 말하며,Hydrogen ion sensitive glass bulb 내외의 수소이온농도 변화에 따라 변화되는 mV 출력을 가집니다. 기준 전극은 수소이온농도에 따라 출력이 변화되지않고 항상 일정한 전위를 가집니다. pH전극은 높은 내부저항을 가지므로 작은 전위변화도 감지할 수 있습니다. pH Meter의 내부저항은 매우중요한 변수이며, 전극의 내부저항보다 1,000배 더 높아야 합니다.
유리막으로 만들어진 용기 내부에 pH를 알고 있는 용액B를 넣어 이것을 시료 A에 담그면 유리막 양쪽에 기전력이 발생합니다. 이때 양쪽용액 A,B에 적당한 전극 E1, E2를 담그면 두 전극 사이에 전위차가 발생하는데 이를 전압계로 측정하면 유리막에 발생하는 기전력을 알 수 있습니다. 유리막이 수소이온의 농도에 따라서만 전위값이 변화하는 성질을 갖는다면 두 전극 사이의 전위차로부터 용액의 pH를 알 수 있습니다.
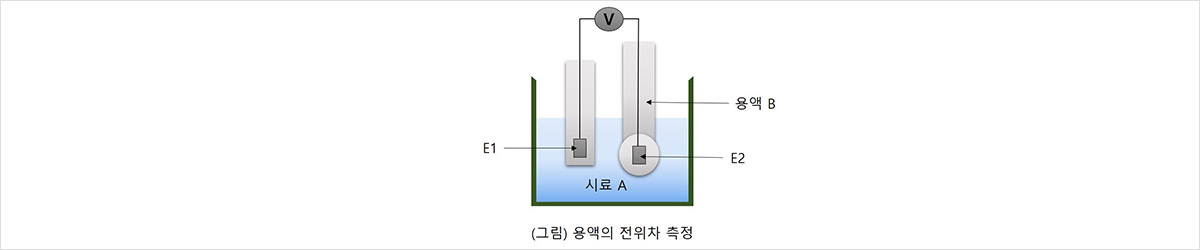
전극의 수명은 사용 기간,사용 빈도,사용 조건,보관 방법 등에 따라 다르며, 다음과 같은 요인의 영향을 받습니다.
- 전극막의 부식
- 오염된 상태에 전극 방치
- 내부 용액의 변질
- 보관 및 관리 상태
- 내부 전극의 부식
정기적인 내부 용액 (3M KCl) 교체 및 표준 용액을 이용한 전극 보정으로 전극 수명을 연장시킬 수 있습니다.




 개인정보취급방침
개인정보취급방침